Федеральный закон от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств"
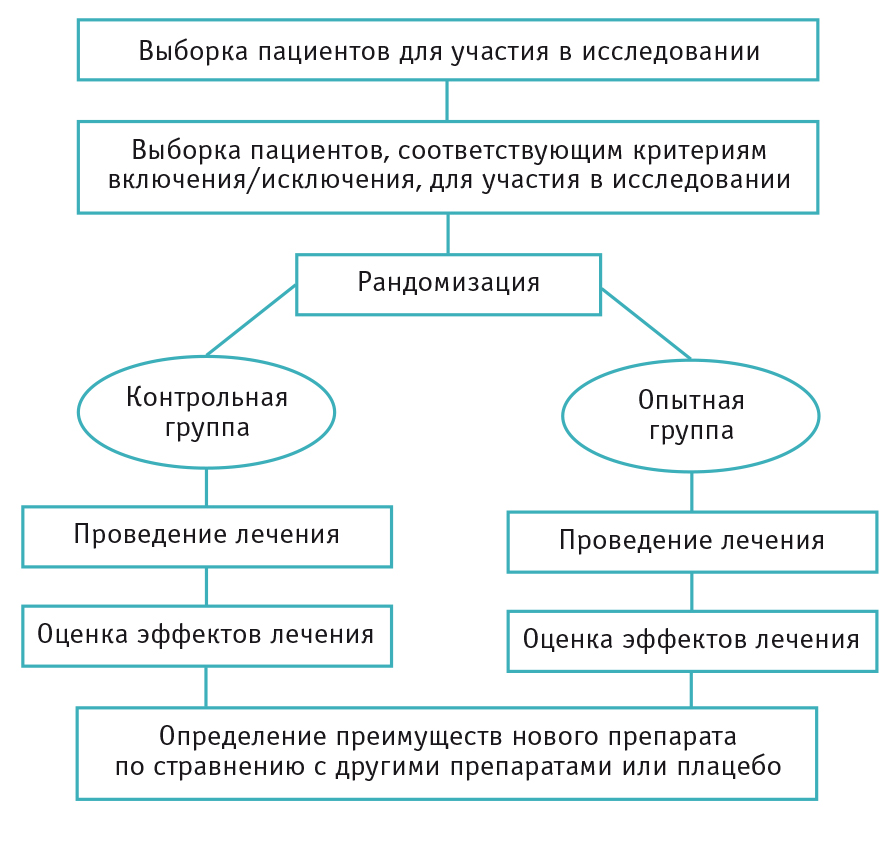
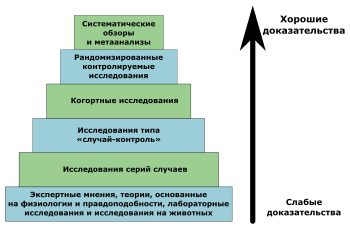
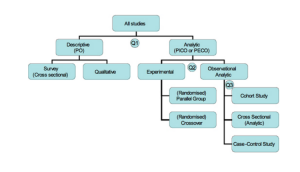
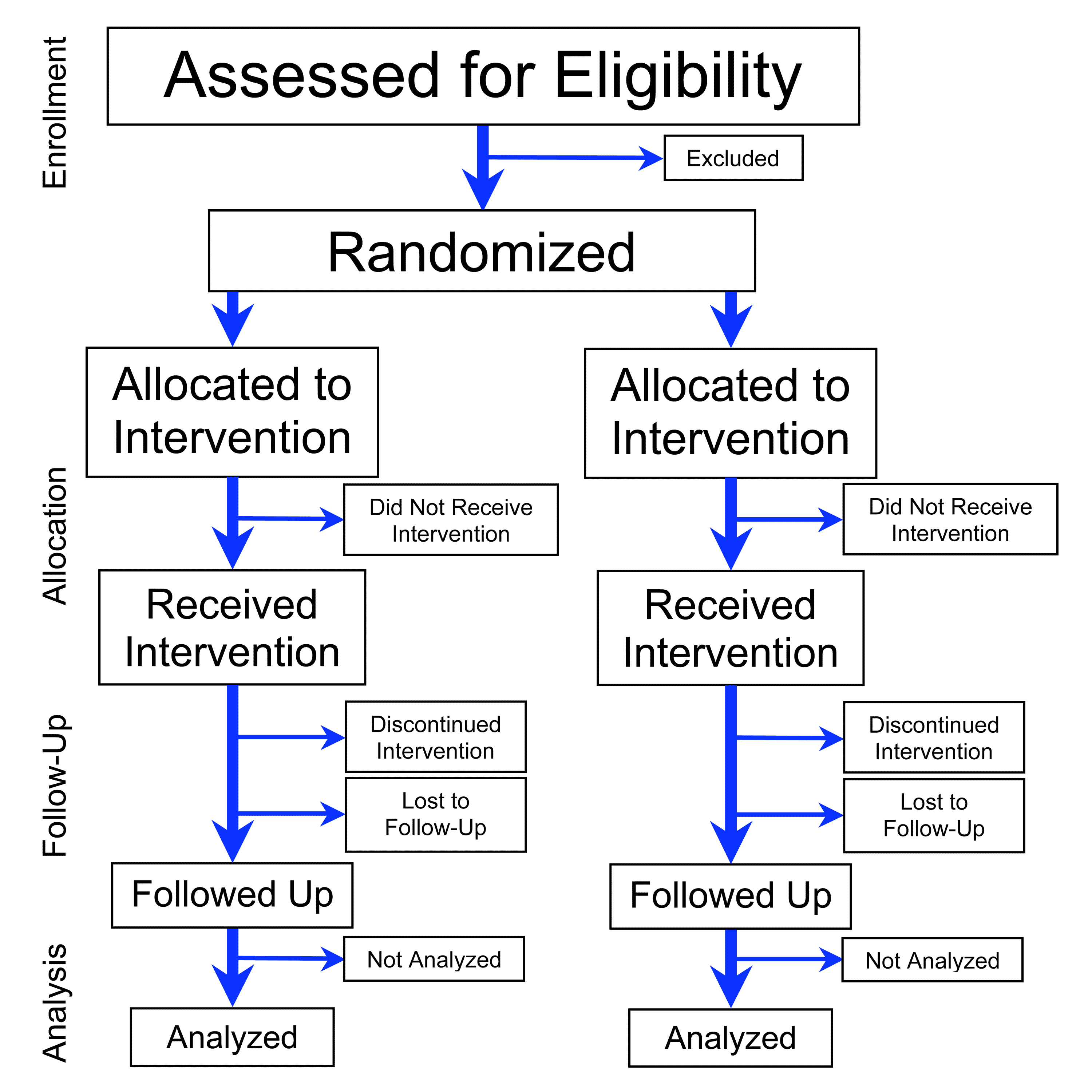
Исследования и разработки в области лекарственных средств. Статистические методы обеспечивают формальный учет факторов, вызывающих различные реакции пациентов на лечение. Использование статистики позволяет специалистам, проводящим клинические исследования, формировать рациональные и точные выводы на основе полученной информации и обосновывать решения в неоднозначных случаях. Статистика лежит в основе предотвращения ошибок и погрешностей при проведении медицинских исследований. В этой статье рассказывается о формировании выборки пациентов для клинических испытаний. Любое клиническое испытание проводится с целью получить информацию об эффекте применяемого лечения для определенной группы пациентов.







.png/640px-WGCNA_outline_(russian).png)


_Clinical_Trial_Design_after_PMID_29490655.png/800px-Schematic_block_diagram_of_Adaptive_(Pharmaceutical)_Clinical_Trial_Design_after_PMID_29490655.png)

Информационно-правовая система нормативных правовых актов Республики Казахстан. Заголовок — в редакции приказа Министра здравоохранения РК от Утвердить прилагаемые правила проведения клинических исследований лекарственных средств и медицинских изделий, клинико-лабораторных испытаний медицинских изделий для диагностики вне живого организма in vitro и требования к клиническим базам и оказания государственной услуги "Выдача разрешения на проведение клинического исследования и или испытания фармакологических и лекарственных средств, медицинских изделий" по перечню согласно приложению 1 к настоящему приказу. Признать утратившим силу некоторые приказы Министерства здравоохранению Республики Казахстан согласно приложению 2 к настоящему приказу. Департаменту науки и человеческих ресурсов Министерства здравоохранения Республики Казахстан в установленном законодательством Республики Казахстан порядке обеспечить:. Контроль за исполнением настоящего приказа возложить на вице-министра здравоохранения Республики Казахстан Гиният А.





Настоящий Федеральный закон регулирует отношения, возникающие в связи с обращением - разработкой, доклиническими исследованиями, клиническими исследованиями, экспертизой, государственной регистрацией, со стандартизацией и с контролем качества, производством, изготовлением, хранением, перевозкой, ввозом на территорию Российской Федерации, вывозом с территории Российской Федерации, рекламой, отпуском, реализацией, передачей, применением, уничтожением лекарственных средств. Настоящий Федеральный закон устанавливает приоритет государственного контроля безопасности, качества и эффективности лекарственных средств при их обращении. Настоящий Федеральный закон применяется к отношениям, возникающим при обращении лекарственных средств на территории Российской Федерации. Законодательство об обращении лекарственных средств состоит из настоящего Федерального закона, других федеральных законов и иных нормативных правовых актов Российской Федерации.